지질 A
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
지질 A는 세균의 세포벽에 존재하는 화합물로, 면역 체계를 활성화하는 강력한 자극제이다. 두 개의 글루코사민 단위와 아실 사슬, 인산기로 구성되며, 아실 사슬의 수와 구조에 따라 면역 반응에 미치는 영향이 달라진다. 지질 A는 면역 반응을 활성화하거나 억제하는 역할을 할 수 있으며, 백신 보조제 및 패혈증 치료제 개발에 활용된다. 톨 유사 수용체 4(TLR4)와 같은 세포 표면 수용체를 통해 작용하며, 구조적 유사체는 수용체 길항제로 사용될 수 있다.
지질 A는 기본적으로 두 개의 글루코사민 단위가 연결되고, 여기에 여러 개의 아실 사슬 (지방산)과 인산기가 결합된 복잡한 구조를 가진다.[1][13]
지질 A 합성에 관여하는 효소는 ''녹농균'', ''대장균'', ''보르데텔라 기관지패혈증균'', 그리고 ''살모넬라속''과 같은 여러 그람 음성균에서 잘 보존되어 있다.[4] 생합성 과정은 UDP-디아실글루코사민 전구체의 합성에서 시작하여 여러 단계를 거쳐 지질 IVa를 형성한다.
LPS의 면역 활성화 능력은 주로 지질 A 부분에서 기인한다. 지질 A는 면역 체계의 매우 강력한 자극제로 작용하여, 밀리리터당 피코그램(pg/mL) 단위의 극소량으로도 단핵구나 대식세포와 같은 면역 세포를 활성화시킨다.
2. 화학적 조성
''대장균''(E. coli)에서의 지질 A 생합성 경로는 크리스찬 R. H. 래츠(Christian R. H. Raetz)의 연구를 통해 밝혀졌다.[2] 지질 A의 구조와 그것이 진핵세포에 미치는 영향에 대한 연구는 1960년대부터 오토 베스트팔, 크리스 갈라노스, 에른스트 T. 리에취엘, 타카하시 하지메 등 여러 연구 그룹에 의해 진행되었다.[2]
2. 1. 구조적 특징
지질 A는 2개의 글루코사민 (아미노당) 단위가 β(1→6) 결합으로 연결된 기본 구조를 가진다.[1][13] 각 글루코사민 단위에는 일반적으로 1개의 인산기가 부착되어 있다.[1][13]
지질 A 분자에는 여러 개의 아실 사슬 (지방산)이 결합되어 있다. 면역 활성화 능력에 가장 효과적인 구조는 총 6개의 아실 사슬을 포함하는 것으로 여겨진다.[1][13] 이 중 4개의 아실 사슬은 글루코사민 당에 직접 부착되며, 주로 탄소 수가 10개에서 16개 사이인 베타 하이드록시 아실 사슬이다.[1][13] 나머지 2개의 추가 아실 사슬은 종종 이 베타 하이드록시 그룹에 부착된다.[1] 예를 들어, ''대장균''(Escherichia coli)의 지질 A는 일반적으로 당에 결합된 4개의 C14 하이드록시아실 사슬과, 베타 하이드록시 그룹에 결합된 C14 아실 사슬 1개 및 C12 아실 사슬 1개를 가지고 있다.[1][13]
3. 생합성
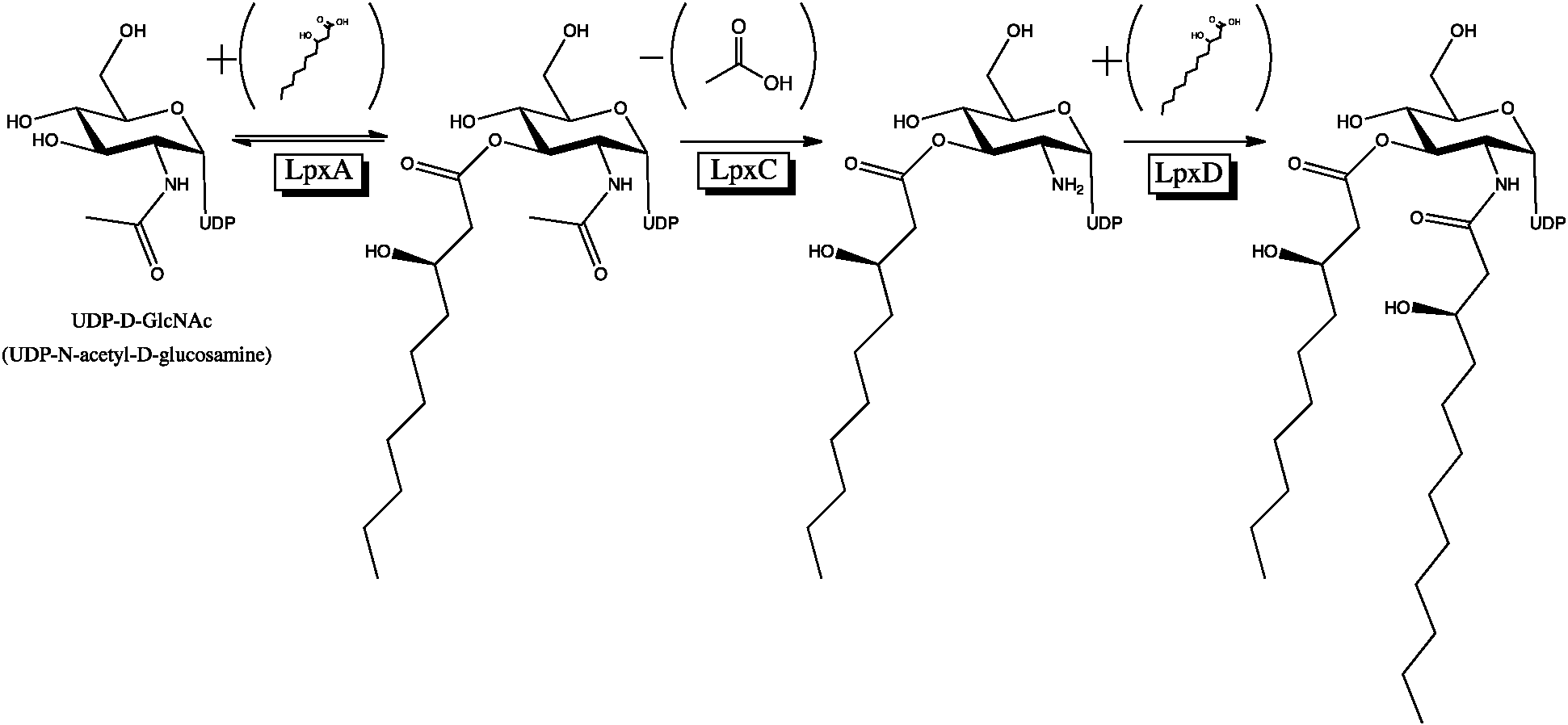
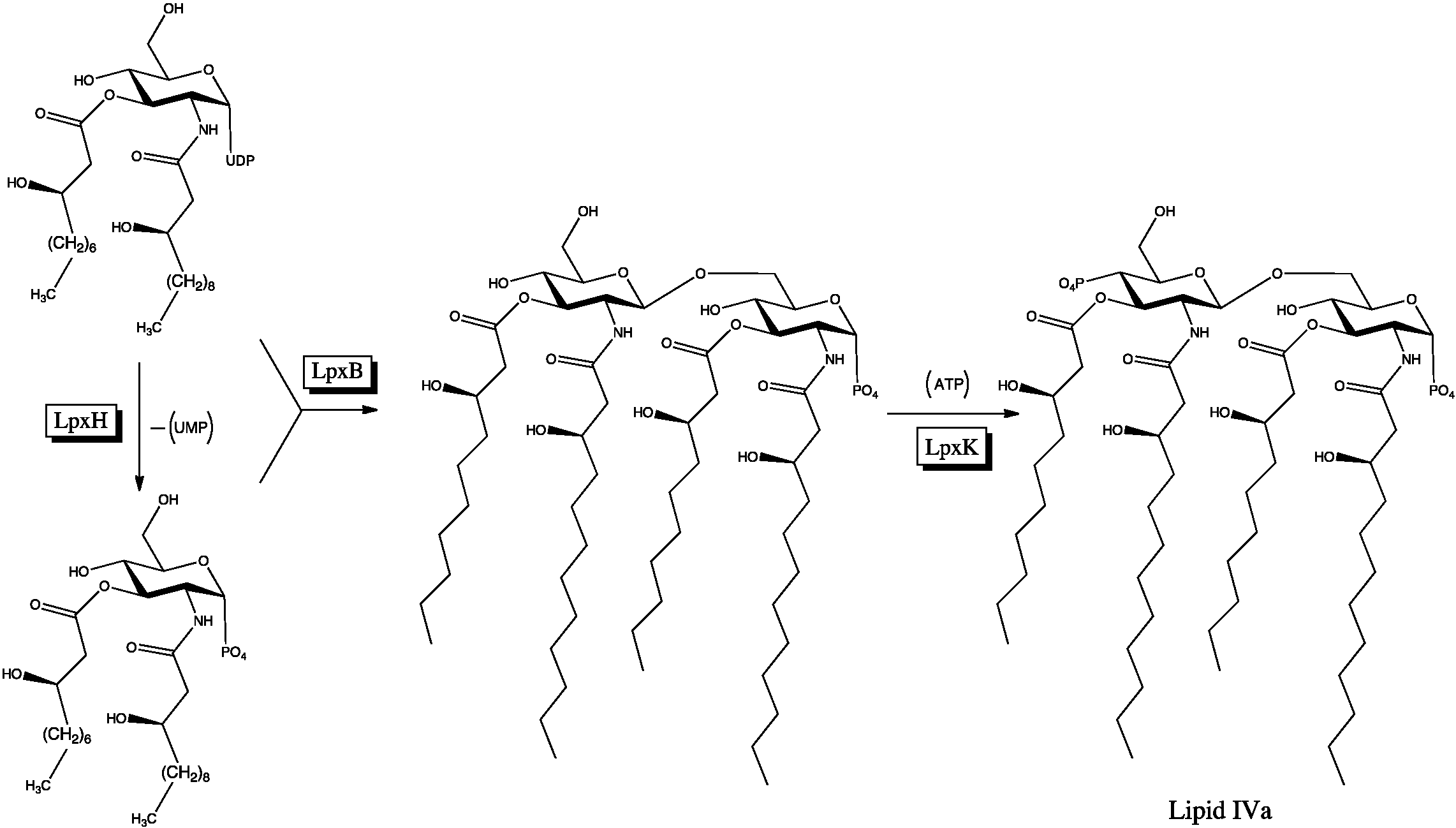
''대장균''에서의 리피드 A 생합성 경로는 Christian R. H. Raetz 등에 의해 1980년대부터 밝혀졌다.[14] 이에 앞서 지질 A의 구조와 진핵 세포에 대한 효과 연구는 Otto Westphal[16]과 Chris Galanos[17], Ernst T. Rietschel[17], Hajime Takahashi[18] 그룹이 각각 1960년대에 시작했다.
4. 면역 반응의 조절
그러나 그람 음성 세균 감염 등으로 인해 체내 지질 A 농도가 과도하게 높아지면, 면역 반응이 통제 불능 상태에 빠져 패혈성 쇼크 (내독소 쇼크)를 유발하고 심각한 경우 사망에 이를 수 있다.
지질 A의 구조적 특징, 특히 아실 사슬의 수는 면역 반응의 강도와 방향을 조절하는 데 중요한 역할을 한다.
이처럼 지질 A의 생물학적 활성은 그 화학 구조에 따라 달라지며, 이는 TLR4/MD-2 수용체 시스템과의 상호작용을 통해 조절된다. 병원성 세균 중 일부는 활성이 낮은 지질 A를 가진 LPS를 만들어 숙주의 면역 반응을 회피하기도 한다. 지질 A의 미세한 구조적 차이가 면역 반응 활성화에 미치는 영향을 이해하는 것은 면역 조절 메커니즘을 밝히고 관련 질환의 치료 전략을 개발하는 데 중요한 통찰력을 제공한다.[8]
4. 1. 면역 반응 활성화
리포다당류(LPS)의 면역 활성화 능력은 주로 지질 A 부분에서 비롯된다. 지질 A는 면역 체계를 매우 강력하게 자극하는 물질로, 밀리리터당 피코그램(pg/mL) 수준의 낮은 농도에서도 단핵구나 대식세포 같은 면역 세포를 활성화시킨다.
지질 A(및 LPS)는 세포 표면에 있는 Toll 유사 수용체 4(TLR4), MD-2, CD14 수용체와 결합하여 세포를 활성화시키는 것으로 밝혀졌다.[20][21][22] 기본적으로 TLR4는 그람 음성 세균의 LPS를 인식하여 선천 면역 반응을 개시하는 데 필수적인 역할을 한다. 이 결합은 세포 내부로 신호를 전달하여 염증성 사이토카인 분비를 촉진하는 등 다양한 면역 반응을 유발한다.
그람 음성 세균 감염 시 체내에 지질 A 농도가 높아지면 면역 반응이 과도하게 일어나 통제 불능 상태가 되어 패혈성 쇼크(내독소 쇼크)를 유발하고 심하면 사망에 이를 수 있다.
TLR4/MD-2 복합체가 다양한 종류의 지질 A에 반응하는 방식은 임상적으로 매우 중요하다. 지질 A의 구조에 따라 면역 반응의 강도가 달라질 수 있기 때문이다.
이처럼 지질 A의 미세한 구조적 차이가 면역 반응 활성화에 미치는 영향을 정확히 이해하는 것은 면역 조절 메커니즘을 밝히고 새로운 치료 전략을 개발하는 데 중요한 단서를 제공할 수 있다.[8]
4. 2. 면역 반응 억제
아실 사슬 수가 감소된 지질 A(예: 4개)는 그람 음성 세균에 의해 유도되는 면역 체계 활성화를 억제하는 효과를 가질 수 있다. 이러한 원리를 이용하여 에리토란(Eritoran)과 같은 합성 지질 A 유사체가 개발되었다. 이 합성 억제제는 그람 음성 세균 감염으로 인한 유해한 영향을 예방하기 위한 약물로서 임상 시험이 진행되었으나, 중증 패혈증 환자에게는 효과가 없는 것으로 확인되어 시험이 중단되었다.[5]
LPS의 생물학적 활성은 지질 A의 화학 구조에 따라 달라지는데, 기본적으로 TLR4 수용체는 그람 음성 세균의 LPS를 인식하여 선천 면역을 활성화하는 데 중요한 역할을 한다.[8] 병원성 세균 중 일부는 생물학적 활성이 낮은 LPS를 만들어 TLR4의 인식을 피하고 숙주의 면역 반응을 약화시켜 생존력을 높이기도 한다. 반대로, 이렇게 활성이 낮은 지질 A는 패혈성 쇼크를 유발할 가능성이 낮다는 특징도 가진다. 따라서 지질 A의 미세한 구조적 차이가 면역 반응 조절에 미치는 영향을 이해하는 것은 중요하다.[8]
4. 3. 면역 증강 (보조제)
변형된 지질 A는 백신의 효과를 높이는 보조제로 사용될 수 있다.[6] 대표적인 예로 단일인산화 지질 A(Monophosphoryl lipid A, MPL)가 있는데, 이는 FDA의 승인을 받은 보조제이다. MPL은 Salmonella minnesotalat R595 균주에서 추출한 지질 A의 혼합물 형태로 만들어진다. MPL에 주로 포함된 지질 A는 원래 구조에서 인산기 하나가 없고, 아실 사슬도 5개만 가지고 있다. 연구에 따르면, 일반적인 지질 A에서 아실 사슬 한두 개를 제거하면 염증 반응을 일으키는 능력이 상당히 줄어드는 것으로 나타났다.[7] 이러한 특성을 이용하여 면역 반응을 안전하게 증강시키는 보조제로 활용하는 것이다.
5. 작용 기전
지질 A는 지질다당류(LPS)의 주요 구성 요소이자 면역 활성화 능력의 핵심적인 부분을 담당한다.[9][10][11] 이는 매우 강력한 면역계 자극 물질로, 피코그램(pg)/mL 수준의 극히 낮은 농도에서도 단핵구나 대식세포와 같은 면역 세포를 활성화시킬 수 있다.
지질 A는 세포 표면에 있는 특정 수용체 복합체, 즉 톨 유사 수용체 4(TLR4), MD-2, CD14와 상호작용하여 세포 활성화 신호를 전달하는 것으로 알려져 있다.[9][10][11][20][21][22] 이들 수용체와의 구체적인 상호작용 방식은 지질 A의 구조에 따라 달라질 수 있으며, 이는 면역 반응의 강도를 조절하는 중요한 요인이 된다.
일반적으로 지질 A는 두 개의 글루코사민(탄수화물/당) 단위가 기본 골격을 이루고, 여기에 여러 개의 아실기(지방산) 사슬과 두 개의 인산기가 결합한 구조를 가진다.[13] 면역 활성화 능력에 가장 효과적인 아실기의 수는 6개로 여겨진다. 예를 들어, ''대장균''(Escherichia coli)의 지질 A는 주로 탄소 수 14개(C14)의 히드록시아실 사슬 4개가 글루코사민에 직접 붙어 있고, 추가로 C14와 C12 아실기 하나씩이 베타-히드록시기에 결합된 형태를 가진다.[13]
그러나 그람 음성균 감염 등으로 인해 생체 내 지질 A 농도가 과도하게 높아지면, 면역 반응이 통제 불가능한 상태가 되어 내독소 쇼크(패혈성 쇼크)와 같은 심각한 상태를 유발할 수 있으며, 심한 경우 사망에 이를 수도 있다.
5. 1. 톨 유사 수용체 4 (TLR4)
지질 A는 지질다당류(LPS)와 함께 세포 표면에 있는 톨 유사 수용체 4(TLR4), MD-2, CD14 복합체를 통해 세포를 활성화시킨다.[9][10][11][20][21][22] 이 과정에서 TLR4는 지질 A를 인식하는 핵심적인 역할을 수행하며, 보조 단백질인 MD-2와 결합하여 지질 A와 상호작용한다.이러한 TLR4의 기능을 이용하여, 에리토란과 같은 지질 A의 구조적 유사체는 TLR4의 작용을 막는 수용체 길항제로 개발되고 있다.[12][23] 이러한 길항제는 그람 음성균 감염 시 발생하는 과도한 염증 반응, 즉 패혈증과 같은 심각한 상태를 치료하기 위한 약물 후보로 연구 중이다.[12][23]
5. 2. MD-2 및 CD14
지질 A와 LPS는 세포 표면에 있는 TLR4, MD-2, 그리고 CD14를 통해 세포를 활성화시키는 것으로 알려져 있다.[9][10][11][20][21][22] 이러한 발견으로 인해 에리토란과 같은 지질 A의 구조적 유사체가 TLR4 수용체 길항제로 작용할 수 있다는 점이 밝혀졌으며, 이는 그람 음성균 감염으로 인한 과도한 염증 반응, 즉 패혈증 치료제 개발로 이어지고 있다.[12][23]6. 임상적 의의 및 연구 동향
지질 A는 면역계에 미치는 영향으로 인해 임상적으로 중요한 의미를 지니며, 이를 바탕으로 다양한 의학적 연구가 진행되고 있다. 특히 패혈증 치료제 개발과 백신의 효능을 높이는 면역 보조제 개발 분야에서 활발한 연구가 이루어지고 있다.
6. 1. 패혈증 치료제 개발
지질 A는 세포 표면의 Toll 유사 수용체 4(TLR4), MD-2, CD14와 상호작용하여 세포를 활성화시킨다.[9][10][11][20][21][22] 이를 바탕으로, 에리토란과 같은 지질 A의 구조적 유사체는 TLR4의 작용을 막는 수용체 길항제로 개발되고 있다. 이 길항제들은 그람 음성균 감염 시 발생하는 과도한 염증 반응인 패혈증을 치료하기 위한 약물로 개발되고 있다.[12][23]다른 접근법으로는 지질 A의 아실기 수를 줄이는 방법이 있다. 예를 들어 아실기 수를 6개에서 4개로 줄인 지질 A는 그람 음성균에 의한 면역 활성화를 억제하는 효과를 보인다. 이렇게 화학적으로 합성된 억제제들은 그람 음성균 감염의 유해한 영향을 방지하기 위한 약물로서 임상 시험이 진행되고 있다.
6. 2. 백신 보조제 개발
지질 A의 구조를 변경한 유도체는 백신의 구성 성분인 면역 보조제로 사용된다.참조
[1]
논문
Discovery of new biosynthetic pathways: the lipid A story
[2]
논문
Lipopolysaccharide endotoxins
[3]
논문
Endotoxin of Neisseria meningitidis composed only of intact lipid A: inactivation of the meningococcal 3-deoxy-D-manno-octulosonic acid transferase
2002-05
[4]
논문
Lipopolysaccharide biosynthesis in Pseudomonas aeruginosa
[5]
논문
Effect of Eritoran, an Antagonist of MD2-TLR4, on Mortality in Patients with Severe Sepsis
[6]
논문
Development and Characterization of Synthetic Glucopyranosyl Lipid Adjuvant System as a Vaccine Adjuvant
[7]
논문
Modulating the innate immune response by combinatorial engineering of endotoxin
2013-01-22
[8]
논문
Structural Relationship of the Lipid A Acyl Groups to Activation of Murine Toll-Like Receptor 4 by Lipopolysaccharides from Pathogenic Strains of Burkholderia mallei, Acinetobacter baumannii, and Pseudomonas aeruginosa.
2015
[9]
논문
Defective LPS Signaling in C3H/HeJ and C57BL/10ScCr Mice: Mutations in Tlr4 Gene
1998-12-11
[10]
논문
The structural basis of lipopolysaccharide recognition by the TLR4–MD-2 complex
[11]
논문
The sole gateway to endotoxin response: how LPS was identified as Tlr4, and its role in innate immunity
2001-04-01
[12]
논문
Phase 2 trial of eritoran tetrasodium (E5564), a Toll-like receptor 4 antagonist, in patients with severe sepsis
[13]
논문
Discovery of new biosynthetic pathways: the lipid A story
[14]
논문
Lipopolysaccharide endotoxins
http://arjournals.an[...]
[15]
논문
Endotoxin of Neisseria meningitidis composed only of intact lipid A: inactivation of the meningococcal 3-deoxy-D-manno-octulosonic acid transferase
http://jb.asm.org/cg[...]
[16]
논문
Biochemical Studies on Lipopolysaccharides of Salmonella R Mutants
[17]
논문
http://www.jstor.org[...]
[18]
논문
Chemical Structure of Lipid A of ''Selenomonas ruminantiwm''
http://jb.oxfordjour[...]
[19]
논문
Lipopolysaccharide biosynthesis in Pseudomonas aeruginosa
[20]
논문
Genetic and physical mapping of the Lps locus: Identification of the Toll-4 receptor as a candidate gene in the critical region
[21]
논문
Limits of a deletion spanning Tlr4 in C57BL/10ScCr mice
[22]
논문
The structural basis of lipopolysaccharide recognition by the TLR4-MD-2 complex
[23]
웹사이트
重症敗血症治療剤「エリトラン(E5564)」の第3相試験を継続
http://www.eisai.co.[...]
2010-03-26
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com